ZACplus Citizen-Science workshop vom 07.06. bis 09.06.2024
Ort: OpenEcoLab Rahden
Teilnehmer: 8
Bei diesem workshop wurde die neue Zelle mit integrierter Zirkulation in Betrieb genommen sowie ein paar kleiner Versuche durchgeführt. Zu unserer positiven Überraschung lief die Zelle wesentlich länger als zunächst erwartet, so dass dieser workshop spontan verlängert wurde bis zum 16.09. und ein erfolgreicher Langzeitversuch durchgeführt werden konnte.
_
_
Experiment 07.06.2024-1
Einführung:
Dieses Experiment gehört noch zu der am 10.05. begonnenen Versuchsreihe mit dem Recycler (Experiment 10.05.2024-2), wobei die Spannung variiert wird. Es wurde bereits mit 2,4V und 4,2V gemessen und jetzt kommt noch eine weitere Messung mit 3,6V hinzu. Die Beschreibung und Darstellung der Ergebnisse aus den vorigen Versuchen sind zu finden unter [1]
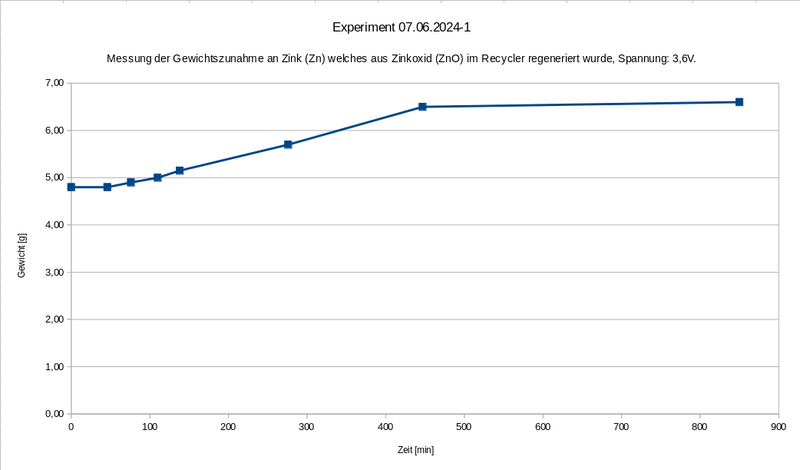
Methoden / Setup: Es geht hier um eine Messung der Gewichtszunahme an Zink (Zn) welches aus Zinkoxid (ZnO) im Recycler gewonnen wird und über mehrere Stunden läuft. In dieser Variation beträgt dabei die vorgegebene Spannung 3,6 V und der dabei von der Zelle gezogene Strom in Ampere ist der zu messende Wert. Dabei lagert sich das Zink an der Gitterelektrode an so dass sich eine Art Zinkschwamm bildet der ständig wächst und an Gewicht zunimmt. Da die Gitterelektrode hängend an einer Federwaage befestigt ist kann die Gewichtszunahme beobachtet und gemessen werden.
Ergebnisse:
Wie bei den vorigen Durchgängen erfolgt auch hier die Zunahme in Form einer linearen Geraden, welche nach ca. 440 Minuten keine weitere Gewichtszunahme mehr zeigt.
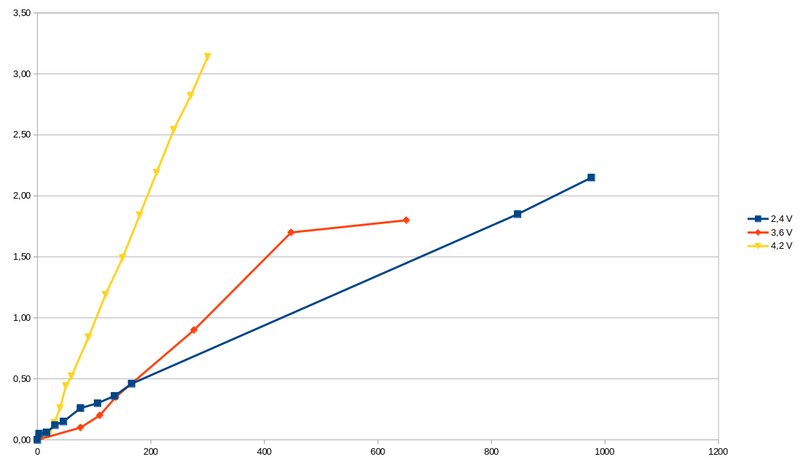
Im folgenden Diagramm sind die Geraden aus den vorigen Versuchen (mit 2,4V und 4,2V) und aus diesem (mit 3,6V) zum Vergleich eingetragen, allerdings ohne den jeweiligen Offset (d.h. nur das reine bzw. netto-generierte Zink-Gewicht) und es wird deutlich, dass mit der Spannung die Steigung zunimmt.
Diskussion:
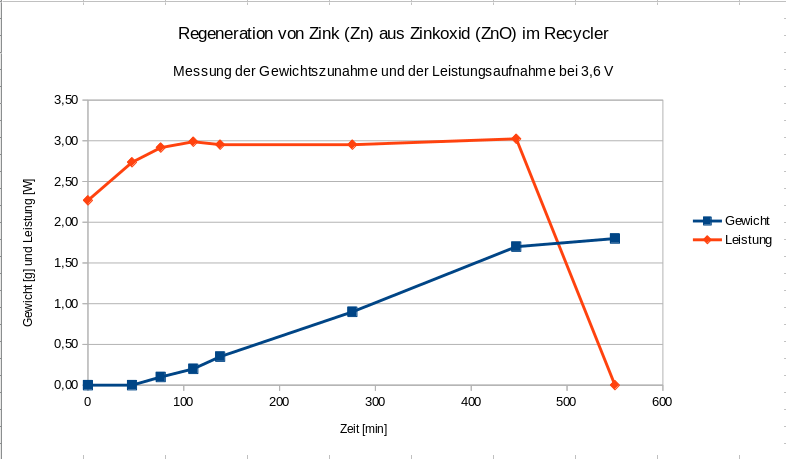
Das heisst, dass ein gegebene Gewichtszunahme, wie zB. 1,50 g desto schneller erreicht wird, je höher die Spannung ist, d.h. bei 4,2V bereits nach rund 150 min, bei 3,6V nach ca. 420 min und bei 2,4V nach ca. 495 min. In dieser Anwendung ist aber nicht die Schnelligkeit der Umsetzung relevant sondern der optimale Stromverbrauch (um einen mglichst guten Wirkungsgrad zu erzielen). Wir haben daher mal im folgenden Diagram exemplarisch für 3,6V die sich aus dem gemessenene Stromfluss ergebende Leistung aufgetragen. Sie verläuft linear und nahezu konstant bei knapp 2,9 Watt, abgesehen von einer kurzen Einschwingphase am Anfang, die wir hier aber vereinfachend mal vernachlässigen wollen. Am Ende fällt sie dann steil ab, weil das verfügbare Zinkoxid verbraucht ist bzw. umgewandelt wurde (und die Gewichtszunahme des Zinks somit ebenfalls deutlich abflacht). Die anderen beiden Spannungen werden hier jetzt nicht gezeigt, aber auch da war der Verlauf linear und nahezu konstant (d.h. horizontal) und betrug bei 2,4V rund 0.8 Watt und bei 4,2V rund 4,3 Watt.
Wenn wir nun diese Werte auf die soeben angegebenen Zeiten zur Regeneration von jeweils 1,5 g Zink beziehen, dann können wir untereinander vergleichen. Um also 1,5 g Zink zu generieren wurden bei 2,4V in 495 min rund 6,6 Wh an zugeführter Energie benötigt. Bei 3,6V waren es 20,3 Wh und bei 4,2 V ergaben sich 10,75 Wh. Intuitiv würde man erwarten, dass die Energiemenge bei 3,6V irgendwo zwischen den anderen beiden Spannungen liegt. Um auszuschliessen, dass es sich hier um ein Mess-Artefakt handelt, sollte der Versuch nochmal durchgeführt werden. Es könnte aber auch andere Ursachen haben und im Messaufbau begründet sein. Wenn man nur 3,6V und 2,4V vergleicht, dann sieht es so aus, dass man mit einer längeren ZeitDauer der Umwandlung einen geringeren Energieverbrauch und ddmit einen besseren Wirkungsgrad erkaufen könnte. Da es bei einer höheren Spannung irgendwann zu vermehrter Wasserstoffbildung kommt, könnte es aber zB. auch sein, dass diese bei 4,2V so ausgeprägt ist, dass das Zinkoxid, welches ja in Pulverform vorliegt, stärker aufgewirbelt wird und somit besser umgesetzt werden kann. Die Elektrode besteht ja aus einem Drahtgitter und das Pulver setzt sich darauf ab, ein Teil des Pulvers rutscht aber durch das Gitter und befindet sich unterhalb (was man auf dem obgen Bild mit dem becherglas gut erkennen kann). An der Umwandlungsreaktion ist aber nur jener Anteil, der sich oberhalb des Gitters befindet, insofern können Verwirbelung (und auch andere Faktoren) das Ergebnis beeinflussen.
Zusammenfassung / Ausblick:
In künftigen Experimenten mit dem Recycler wird es darum gehen, den Stromverbrauch bei der Zink-Regenerierung weiterhin zu optimieren, da dieses essentiell für einen guten Wirkungsgrad ist. Die bisherigen Versuche sind eher als eine Art Vorversuche anzusehen, um sich an die Sache heranzutasten. Aber sie sagen noch nichts über einen erreichbaren Minimal-Stromverbrauch aus, da dieser von vielen unterschiedlichen Faktoren abhängen kann, wie zB. die Größe bzw. Fläche der Elektroden, deren Abstand zueinander, aus welchem Material sie bestehen, die Art und Weise wie das Zinkoxid in das System eingebracht wird usw. Was aber auch ganz ok ist, denn dadurch ergeben sich noch etliche Möglichkeiten zur Optimierung.
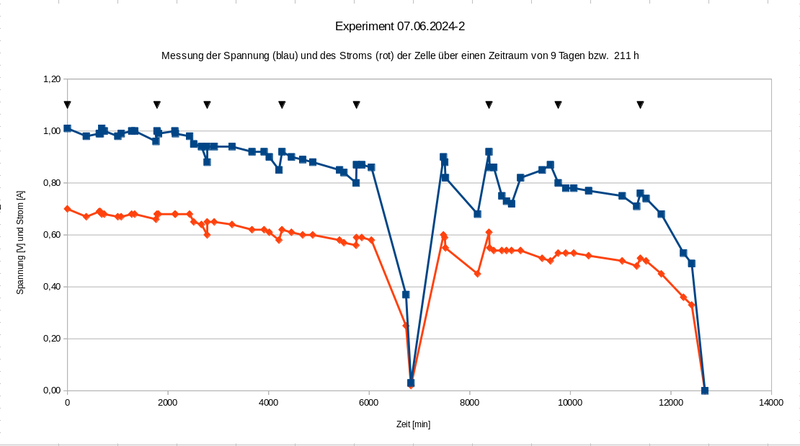
Experiment 07.06.2024-2
Einführung:
Bei diesem Experiment geht es um die Einführung des neuen Prototyp 1B, der sich insbesondere durch eine Elektrolyt-Zirkulation auszeichnet und somit einen wichtigen Enwticklungsschritt markiert. In der Vergangenheit hatten wir bislang immer mit einem geschlossenen System gearbeitet (dem sog. "Kathodentester") mit welchem sich die Stromerzeugung auch sehr gut darstellen und messen liess, allerdings immer nur für einige Stunden, ehe die Leistung der Zelle dann irgendwann bis auf Null runter ging.
Dabei war zu beobachten, dass sich der anfangs klare Elektrolyt im Laufe des Versuchs immer weiter mit dem weisslich-grauen Zink-Oxid anreicherte. Eine Mögliche Ursache des Niedergangs könnte also darin bestehen, dass sich die Poren der Gaskathode (= GDL, GAs Diffusion Layer) allmählich mit ZnO zusetzen und dann irgendwann nach einigen Stunden nicht mehr funktionieren.
Allerdings sind aus der Literatur auch noch weitere Faktoren bekannt, welche die Lebensdauer der GDL limitieren können. Da wäre zB. die Carbonatisierung zu nennen, bei der in der Luft enthaltenes Kohlendioxid (CO2) mit dem Elektrolyt (KOH) reagiert und sich Kaliumcarbonat (K2CO3) bildet, nach der Formel
und das Kaliumcarbonat dann die Poren der GDL verstopft.
Noch eine weitere Möglichkeit wäre auch ein "absaufen" der GDL ("premature GDL flooding")[1] , wobei die Frage wäre, nach wieviel Arbeitsstunden dieses denn geschähe, also auch wieder die Frage nach der Lebensdauer der GDL. Die Literatur sagt dazu, dass diese höchst unterschiedlich sein kann, von wenigen Stunden bis zu mehreren tausend Stunden; es hängt wohl sehr stark davon ab, in welchem System bzw. mit was für einer Zellchemie das System betrieben wird.[2]
Um solche die GDL-Lebensdauer begrenzenden Faktoren näher untersuchen zu können, ist es daher notwendig, das das System länger als nur ein paar Stunden läuft. Eine ausführliche Erläuterung dazu findet sich auch in diesem Video:https://www.youtube.com/watch?v=QRqRMy4RytU
Als weitere Ursache wäre übrigens (der Vollständigkeit halber) noch "Brennstoffmangel" zu nennen, also wenn etwa das Zink, welches hier als Anode in Form von dünnen Platten zugeführt wird, schlichweg verbraucht und zu Energie umgewandelt worden ist. Dies äussert sich dann in Form von riesigen Löchern in der Platte und ist dadurch aber auch als Ursache klar und eindeutig zu identifizieren und hat auch ursächlich nichts mit einer etwaigen Degradation der Gaskathode zu tun..
Um die ZnO-Verstopfung der GDL-Poren als mögliche Ursache für den Niedergang selektiv zu belegen und darzustellen bietet sich als naheliegende Möglichkeit eine Elektrolyt-Zirkulation an, bei welcher der in zunehmenden Maße mit ZnO angereicherte Elektrolyt abtransportiert und durch frischen Elektrolyt (oder zumindest einen mit einer geringeren ZnO-Konzentration) ersetzt wird. Falls ZnO-Verstopfung die (oder zumindest eine der wichtigsten) Ursache(n) für den Niedergang ist, dann sollte sich die Laufzeit des Systems dadurch signifikant verlängern lassen.
Methoden / Setup:
Es wurde ein Tank mit 2L-Tank für den frischen Elektrolyt und als Puffertank bei der Zirkulation vorgesehen. Dabei ist der Pufferinhalt mit ca. ein bis anderthalb Liter Elektrolyt vergleichsweise groß gegenüber dem Volumen der Zell-Kammer.
Ergebnisse:
Wie bei den
Diskussion:
Das heisst, dass
Wenn wir nun
Zusammenfassung / Ausblick:
In künftigen Experimenten
References:
Einzelnachweise
Literatur und Links
| Referenz | Beschreibung |
|---|---|
| [2] | Ein Video vom dritten Tag des workshops, welches livestream-artig den Bau des Interfaces zeigt. |